线粒体丙酮酸载体(MPC,mitochondrial pyruvate carrier)是存在于线粒体内膜一种蛋白复合体,负责将丙酮酸从线粒体外运输到线粒体基质中以产生乙酰CoA。自从2012年MPC在酵母和果蝇中被发现和鉴定之后,一系列关于MPC功能的研究相继开展,但是大多数集中在动物或酵母中,以理解它们在代谢性疾病中的功能【1-2】。2014年,9159金沙游戏场张伟教授等在 Molecular Plant 报道了拟南芥中MPC家族的同源基因NRGA1在ABA调控的保卫细胞信号传导中的作用【3】;2017年,张伟教授等又在BMC Plant Biology发表论文,表明MPC1同源基因可以通过调节拟南芥中的丙酮酸含量来介导ABA调节的气孔关闭和干旱响应【4】。但是目前还没有证据表明MPC蛋白可以参与植物丙酮酸代谢和TCA循环。
近日,张伟教授课题组与山东省农业科学院高建伟研究员课题组又在 Plant Physiology 在线发表了一篇题为Mitochondrial Pyruvate Carriers Prevent Cadmium Toxicity by Sustaining the TCA Cycle and Glutathione Synthesis 的研究论文,报道了拟南芥MPC蛋白对丙酮酸代谢和TCA循环的影响及其调控植物镉(Cadmium,Cd)耐受性的机理。
该研究首先通过AtMPC突变体(mpc1-1,mpc1-2,nrga1和mpc3-1)验证了其对植物Cd耐受性的影响,发现在Cd胁迫后,mpc1-1和mpc1-2的根长度显著减少,而通过构建mpc1-1(AtMPC1)互补转基因系可以恢复mpc1-1的根长表型,表明AtMPC1是拟南芥耐Cd所必需的。之前在哺乳动物、酵母和拟南芥中的研究均表明,MPC1可以与其他MPC组分形成蛋白质复合物【1-2】。本研究发现AtMPC1可以与另一种AtMPC(AtNRGA1,AtMPC2或AtMPC3)相互作用形成三种AtMPC复合物。通过利用CRISPR/ cas9系统构建了MPC组合的双重、三重和四重突变体,发现在Cd胁迫后,双重和四重突变体植物的根长变得更短。包含AtMPC1的多重突变体的Cd敏感性与mpc1-1无显著差异,并且敲除另外三种AtMPC的三重突变体对Cd处理也敏感,表明另外几种MPCs的功能冗余。在酵母和一些动物中,MPC的缺失会影响丙酮酸从细胞质向线粒体基质的转运从而影响乙酰CoA的产生和TCA循环。但是在植物中是否也具有相似的作用呢?该研究利用mpc1-1研究了AtMPC复合物响应Cd胁迫的分子机制。在正常条件下,mpc1-1的乙酰CoA含量与野生型相同,但是Cd胁迫后,mpc1-1中的乙酰-CoA含量显着降低。代谢分析显示,mpc1-1植株的丙酮酸浓度显著升高,而TCA循环中间体的含量在Cd胁迫后显着降低。这表明mpc1-1植株在Cd胁迫下丙酮酸运输受阻,不能有效产生乙酰CoA。mpc1-1线粒体中的乙酰CoA和丙酮酸含量在Cd胁迫后显著降低,这进一步证明了该假设。
谷胱甘肽(GSH)可以螯合Cd2+以减轻Cd毒害。该研究发现,正常条件下mpc1-1中GSH合成被显著抑制,而Cd胁迫后,mpc1-1中的GSH水平远高于野生型。作为植物中GSH的主要来源,谷氨酸含量也受到MPC的影响。谷氨酸氧化是维持TCA循环的必要旁路,在该途径中,谷氨酸可以通过谷氨酰胺酶(GLS)转化,然后通过谷氨酸脱氢酶(GDH)脱氨基以驱动TCA循环【5】。正常条件下,mpc1-1中谷氨酸含量显著降低而Cd胁迫后降低更为显著。而进一步通过同位素示踪试验发现,在Cd胁迫后,mpc1-1中13C(13C—葡萄糖,丙酮酸前体)的丰度降低而15N(15N—谷氨酸)的丰度无显著变化。这些结果表明当AtMPC功能缺失时,谷氨酸的消耗被提高以补充更多GSH应对Cd胁迫。
总之,该研究表明AtMPC是植物调节Cd耐受性所必需的,并且MPC的功能在植物,微生物和动物中是保守的。
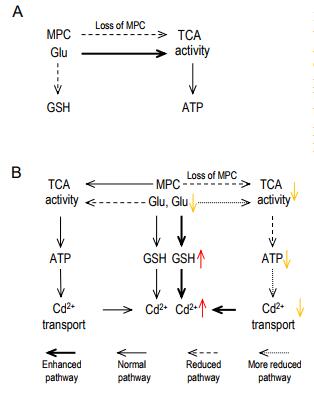
MPC调控植物耐Cd的作用模式图
参考文献
【1】Bricker DK, Taylor EB, Schell JC, Orsak T, Boutron A, Chen YC, Cox JE, Cardon CM, Van Vranken JG, Dephoure N, Redin C, Boudina S, Gygi SP, Brivet M, Thummel CS, Rutter J (2012) A mitochondrial pyruvate carrier required for pyruvate uptake in yeast, Drosophila, and humans. Science 337: 96-100
【2】Herzig S, Raemy E, Montessuit S, Veuthey JL, Zamboni N, Westermann B, Kunji ER, Martinou JC (2012) Identification and functional expression of the mitochondrial pyruvate carrier. Science 337: 93-96
【3】Li CL, Wang M, Ma XY, Zhang W (2014) NRGA1, a putative mitochondrial pyruvate carrier, mediates ABA regulation of guard cell ion channels and drought stress responses in Arabidopsis. Mol Plant 7: 1508-1521
【4】Shen JL, Li CL, Wang M, He LL, Lin MY, Chen DH, Zhang W (2017) Mitochondrial pyruvate carrier 1 mediates abscisic acid-regulated stomatal closure and the drought response by affecting cellular pyruvate content in Arabidopsis thaliana. BMC Plant Biol 17
【5】Bender T, Martinou J-C (2016) The mitochondrial pyruvate carrier in health and disease: To carry or not to carry? Biochim. Biophys. Acta 1863: 2436-2442
论文原文链接:
http://www.plantphysiol.org/content/early/2019/02/15/pp.18.01610
