蛋白质编码基因的表达,即由基因组上的遗传信息产生有功能蛋白质的过程,需要经历转录和转录后两个阶段。转录后事件是指信使RNA(mRNA)从基因组DNA转录出来后所经历的剪接、运输、定位、修饰、翻译和降解等过程。与转录调控相比,转录后调控的重要性实际上是被低估的。其实基因表达的转录后调控广泛存在于几乎所有的发育过程中,在早期胚胎发育和某些器官特别是晶状体的发生过程中显得尤为重要,因为这两个发育过程的转录事件在很长一段时间内处于缺失状态。在胚胎卵裂过程中,细胞核的转录活性长时间处于沉默状态,母源mRNA翻译成蛋白质的效率和时空特异性完全依赖于转录后调控机制。而在晶状体纤维细胞分化的末期,为了使晶状体透明并具备折光能力,细胞核和其他细胞器会退化降解,于是就会导致mRNA转录的迅速停止。而与此同时,决定晶状体透明和折光性能的晶体蛋白(crystallins)会积累到高达0.45 g/mL的浓度1,2。这些透明蛋白的大量积累只能依靠细胞核降解前所积蓄的mRNA的高效翻译,所以关于晶状体发育的一个重要科学问题是控制晶体蛋白基因mRNA高效翻译的转录后调控机制是什么?
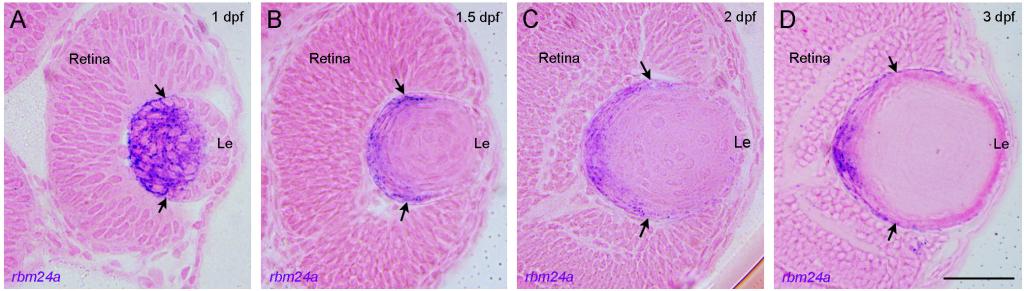
图一、rbm24a基因在晶状体纤维细胞分化过程中特异表达
蓝紫色信号显示的是rbm24a基因的mRNA。Le:晶状体上皮细胞层(Lens epithelium)
转录调控的主要执行者是结合DNA的转录因子,而转录后mRNA的代谢过程则主要依靠RNA结合蛋白。因此对上述科学问题的回答有赖于寻找在晶状体特异表达并且有功能的RNA结合蛋白。9159金沙游戏场邵明教授和广东医科大学附属医院石德利教授课题组发现了一个RNA结合蛋白Rbm24a,该基因除了表达在心脏和骨骼肌外,在感觉器官基板,尤其是晶状体中也有非常特异的表达。进一步通过组织切片发现该基因非常特异的表达在正在分化的初级和次级纤维细胞的胞质中。在模式动物斑马鱼中对该基因进行全身性敲除和心脏拯救实验,发现rbm24a的缺失将会导致晶状体浑浊即白内障,这是造成失明的重要原因,而小眼畸形和细胞核退化的缺陷则是突变体缺少血液循环的间接表型。
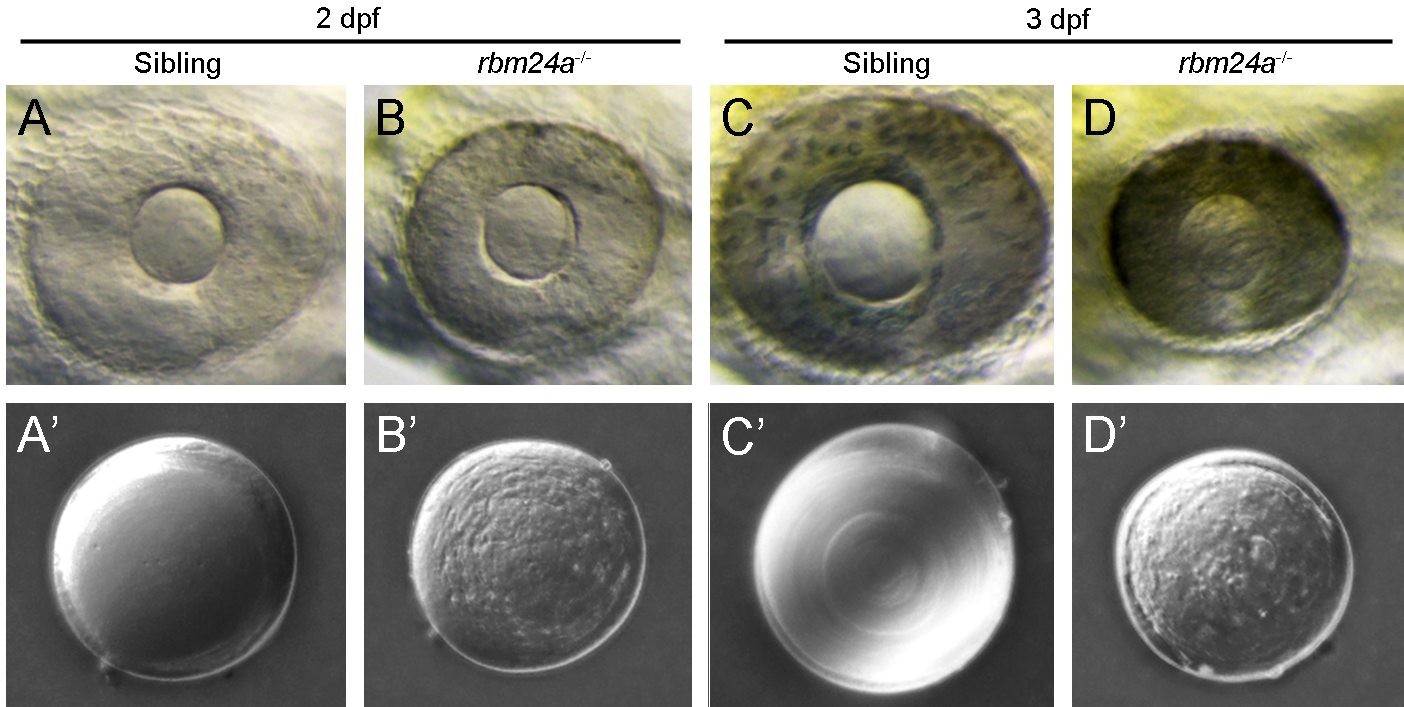
图二、rbm24a突变导致晶状体浑浊(白内障)
通过RNA-seq和定量蛋白质谱,研究者发现几乎所有的晶体蛋白基因(crystallins)和热休克蛋白家族基因(hsps)的表达在突变的晶状体中都发生明显的下调,而这种现象的原因有两个方面,一是以热休克蛋白基因为代表的mRNA稳定性下降,另一个是结构性晶体蛋白基因mRNA的poly(A)尾巴明显变短。分子机理方面,研究人员进一步证明Rbm24a可以通过其RRM结构域结合晶状体特异表达的mRNA,而且Rbm24a可以通过其C端结合胞质多腺苷酸化复合物(cytoplasmic polyadenylation complex,CPA complex)关键成员Cpeb1b和Pabpc1l来促进mRNA在细胞质加poly(A)的过程,从而增强晶状体特异表达mRNA的稳定性和翻译效率。
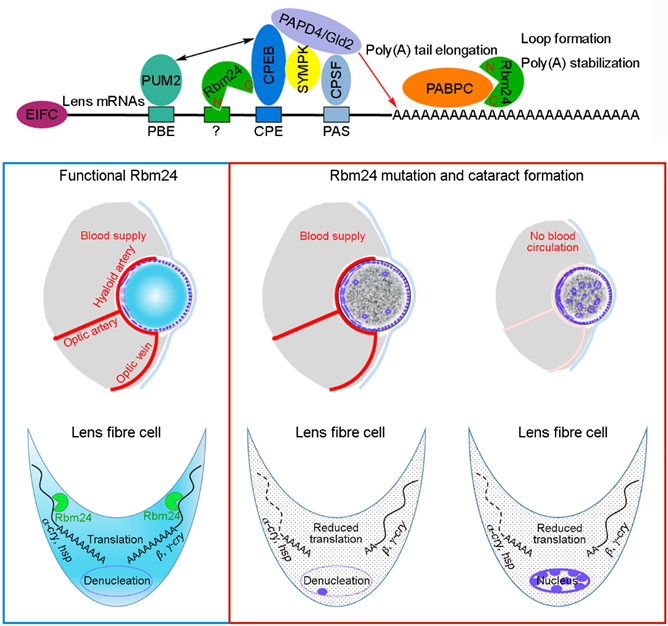
图三、Rbm24a通过胞质多腺苷酸化复合物(CPA complex)控制晶体蛋白基因mRNA翻译效率和防止白内障发生的分子机制
因此这项工作凸显了转录后调控机制在发育过程中的重要性,证明Rbm24a是调控晶状体终末分化和透明的关键转录后调控因子,其在细胞质中通过胞质多腺苷酸化机制控制mRNA poly(A)尾的长度来调节晶状体特异mRNA的翻译效率。由于rbm24基因在不同物种中序列和表达模式高度保守,该工作因此也提示人类RBM24基因转录调控元件的突变可能是导致先天性白内障的原因,解析该基因的功能对老年性白内障的治疗也具有潜在的借鉴意义。
该项成果于2020年3月13日在线发表在PNAS上,题目为“Rbm24 controls poly(A) tail length and translation efficiency of crystallin mRNAs in the lens via cytoplasmic polyadenylation”。9159金沙游戏场动物细胞和发育生物学山东省重点实验室邵明教授和广东医科大学附属医院石德利教授为共同通讯作者。9159金沙游戏场为该论文的第一作者单位,硕士生陆通、博士生张冲、硕士生张伊庄和孔淑慧为这项工作做出了重要贡献。该工作得到了国家自然科学基金面上项目、山东省自然科学基金、9159金沙游戏场青年学者未来计划和齐鲁青年学者项目的支持。

文章链接:https://www.pnas.org/content/early/2020/03/12/1917922117
参考文献:
1. Cvekl, A. & Zhang, X. Signaling and Gene Regulatory Networks in Mammalian Lens Development. Trends Genet 33, 677-702, doi:10.1016/j.tig.2017.08.001 (2017).
2. Bassnett, S. & Costello, M. J. The cause and consequence of fiber cell compaction in the vertebrate lens. Exp Eye Res 156, 50-57, doi:10.1016/j.exer.2016.03.009 (2017).
