近日,9159金沙游戏场丁兆军教授团队在Molecular Plant杂志(IF: 21.949)上以Article形式在线发表了题为NAC1 regulates root ground tissue maturation through coordinating with SCR/SHR–CYCD6;1 module in Arabidopsis的研究论文。该研究揭示了拟南芥NAC转录因子家族成员NAC1协同SHR/SCR-CYCD6;1模块调控植物根基本组织成熟(root ground tissue maturation)的分子机制。

植物根系发育过程在时空上是一个非常有序的精确组装过程。在模式植物拟南芥根中,皮层/内皮层干细胞通过两次连续的不对称分裂(Asymmetric Cell Division, ACD)产生皮层和内皮层两层细胞,它们共同被称为根基本组织(root ground tissue)。随后,内皮层细胞通过一次ACD,一个母细胞分裂形成两个不同的子细胞,其中一个子细胞继承母细胞的内皮层属性,而另一个子细胞则向外分化成中间皮层(Middle Cortex, MC)。中间皮层的形成标志着根基本组织的成熟。已有的研究表明,核心转录因子SHORT ROOT(SHR)和SCARECROW(SCR)在皮层/内皮层干细胞的不对称分裂及根基本组织成熟过程中起到至关重要的作用。然而,SHR/SCR精确控制CYCD6;1的时空特异性表达和内皮层不对称分裂的分子机制多年来一直是个悬而未解的科学问题。
该研究发现NAC1蛋白在主根基本组织处高表达,并且其突变体具有根尖MC形成显著增加的表型,而超表达NAC1转基因系根尖MC形成明显降低,说明NAC1负调控MC的形成。CYCD6;1作为重要的细胞周期调控因子参与内皮层细胞的不对称分裂。通过细胞生物学等技术发现CYCD6;1的表达在nac1突变体内皮层细胞中明显增多,此外,遗传杂交实验证明CYCD6;1作为NAC1的下游调控因子参与MC的形成。进一步通过生物化学、分子生物学等手段揭示NAC1通过N端的EAR 结构域招募转录共抑制子TPL直接结合CYCD6;1的启动子并抑制其转录,从而防止根尖MC的过早成熟。与之对应的,tpl突变体表现出和nac1突变体类似的MC形成显著增加的表型。这些结果表明,NAC1-TPL模块在根内皮层细胞不对称分裂中起着重要的调控作用。
SHR和SCR在MC的形成过程中起到至关重要的作用。scr突变体表现出MC过早成熟的表型,而shr突变体则导致MC的形成完全缺失。该研究通过遗传杂交发现scr/nac1双突变体的表型和scr单突变体类似,而shr/nac1双突变体的表型和shr单突变体相似,说明SCR及SHR位于NAC1的遗传学上位参与MC的形成。
为了进一步解析NAC1如何参与SHR/SCR信号途径,该研究通过酵母双杂交,BiFC和CoIP等实验手段验证了NAC1与SHR/SCR蛋白的互作。后续的实验证明,NAC1-TPL和SCR形成复合体以协同的方式抑制CYCD6;1表达,而NAC1与SHR蛋白通过拮抗的方式抑制各自结合下游CYCD6;1的能力及转录表达,从而维持根尖正常的发育进程和MC分裂水平。在NAC1功能缺失后,一方面SCR抑制CYCD6;1转录表达的能力下降,另一方面NAC1拮抗SHR结合CYCD6;1启动子的能力也降低,最终体现出SHR转录诱导CYCD6;1的上调表达和根尖MC分裂水平的显著升高。
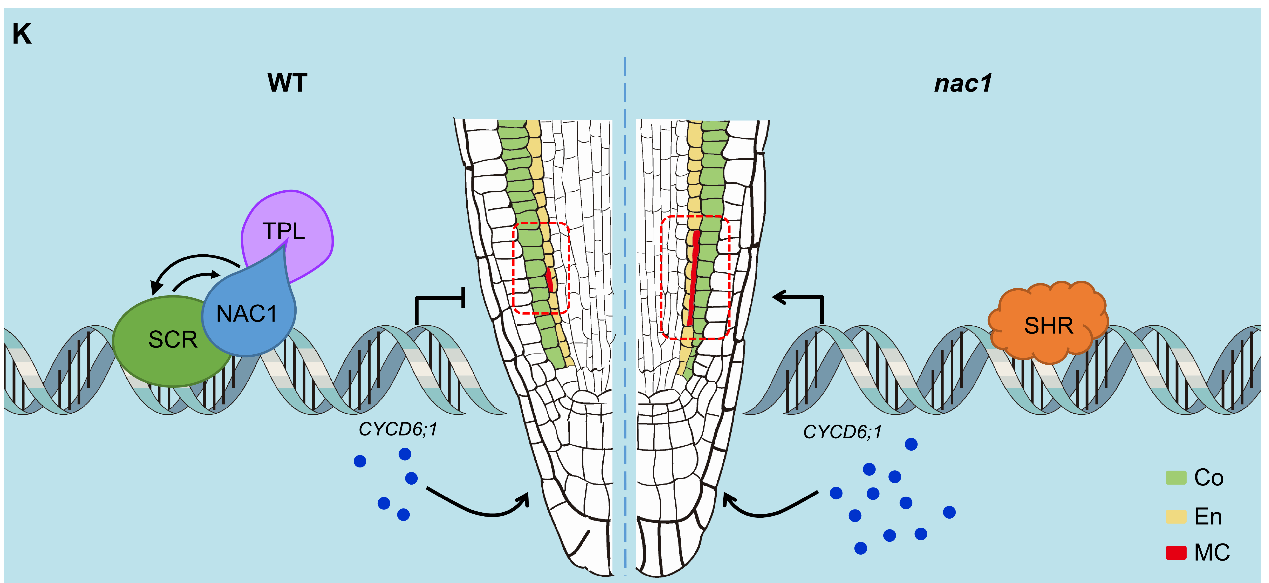
综上所述,该研究解析了NAC1-TPL模块如何与核心转录因子SCR/SHR模块整合精准调控CYCD6;1的时空表达,进而调控根尖正常的发育进程和MC时序产生的分子机理。
9159金沙游戏场博士生谢传恬为论文第一作者,丁兆军教授和孔祥培教授为论文的共同通讯作者。9159金沙游戏场李翠玲副教授和山东农业大学张宪省教授参与了该项工作。中科院遗传所谢旗研究员、中科院植物所王雷研究员、中科院植物所刘永秀研究员、福建农林吴双教授和中科院分子植物科学卓越创新中心徐麟研究员提供了实验材料。该研究得到了国家自然科学基金、山东省自然科学基金重大基础研究项目、山东省优秀青年科学基金、9159金沙游戏场齐鲁青年学者、9159金沙游戏场青年交叉科学创新群体等的资助。
丁兆军教授团队主要开展根系可塑性生长发育与植物环境适应机理的研究,近三年来取得一系列进展:揭示生长素通过BZR1调控下胚轴伸长的分子机制(Sci Adv., 2023);揭示了ARF7介导的生长素信号调控植物下胚轴重力响应过程中生长素浓度梯度建立的新机制 (J Integr Plant Biol., 2022);发现生长素介导植物益生菌通过增加侧根的发生提高植物生物量的新机制(J Exp Bot., 2022);阐明盐胁迫通过MPK3/6磷酸化细胞分裂素响应因子ARR1/10/12并导致其降解从而减弱植物体内的CK信号的新机制 (EMBO Rep., 2021) ;阐明了MPK14-ERF13-KCSs分子模块介导非经典信号通路调控侧根发生的分子机制(Mol. Plant, 2021);揭示了生长素调控根发育的细胞特异性效应机理(Plant J., 2021);阐释了MPK14-IAA33介导的生长素信号通过自我反馈抑制维持根尖干细胞稳态的分子机制(EMBO J., 2020);发现病原菌通过挟持生长素以加速侧根起始,并借此完成对植物的入侵(Cell Rep., 2020);揭示了PIFs-ARF18-QQS分子模块介导生长素信号调控植物的庇荫响应(New Phytol., 2020);发现ARF7介导的生长素信号通过影响细胞壁延展性调控侧根的发生(PLoS Genet., 2020)。
论文链接:https://doi.org/10.1016/j.molp.2023.02.006
